重要的醫學AI應用:使用多模態 CNN-DDI 預測藥物間相互作用事件
生病時,醫生往往給我們開了多種藥物,這些藥物在同時服下時是否因為藥物間相互作用產生對身體不良的效果,這引起我們的懷疑和擔心。其實醫生所開的藥方的藥品已經經過了藥物間相互作用的實驗和臨床測試,我們不應對此產生疑慮。
藥物間相互作用(DDI)是指當一個患者同時服用多種藥物時,藥物之間可能發生的反應,這些反應可能會影響藥物的效果和安全性,甚至導致嚴重的不良后果。所以預測和避免 DDI 是藥物研發和臨床治療中的一個重要問題。但是由于藥物的種類和數量龐大,以及 DDI 的復雜性和多樣性,要通過實驗和臨床測試來檢測所有可能的 DDI 是非常困難和昂貴的。因此利用人工智能(AI)技術來預測 DDI 是一種有效和快速的替代方案。
近年來,AI 領域的深度學習技術在處理圖像、文本、語音等多種類型的數據方面取得了突破性的進展,為 DDI 預測提供了新的思路和方法。其中,卷積神經網絡(CNN)是一種強大的深度學習模型,能夠從數據中自動提取特征,并進行分類、回歸、聚類等任務。CNN 在圖像處理方面的優勢已經被廣泛證明,但是它也可以用于處理其他類型的數據,如藥物的化學結構、酶、途徑和靶點等。通過將不同類型的數據作為 CNN 的輸入,并將它們融合為一個統一的輸出,可以實現對 DDI 的多模態分析和預測。
本文介紹了一篇最新發表在著名《自然》雜志Scientific Reports上的論文,該論文提出了一種基于多模態 CNN 的 DDI 預測方法,稱為多模態 CNN-DDI。該方法利用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。該方法在 DrugBank 數據庫上進行了實驗,該數據庫包含了 572 種藥物和 74528 個相互作用。該方法在準確率和 AUPR 等評估指標上均優于其他方法,并且能夠有效地識別不同類型的 DDI。該方法對于藥物的安全性和有效性具有重要的意義,也為藥物的機制和功能的研究提供了一個新的視角和方法。
論文作者是來自巴基斯坦巴里亞大學計算機科學系的Muhammad Asfand-e-yar, Qadeer Hashir & Waqar Khalil 、美國佛羅里達國際大學的Asghar Ali Shah 、沙特卡西姆大學的Hafiz Abid Mahmood Malik三位專家,他們在 AI 和生物信息學方面有著豐富的經驗和成果。他們的研究受到了巴基斯坦高等教育委員會的資助,也得到了國際同行的認可和贊揚。他們的研究創新點主要有以下幾個方面:
1)他們提出一種基于多模態 CNN 的 DDI 預測方法,該方法能夠處理和融合不同類型的藥物特征,如化學結構、酶、途徑和靶點,從而實現對 DDI 的全面和準確的分析和預測。
2)他們采用一種基于 Jaccard 相似度的相似度矩陣作為 CNN 的輸入,該相似度矩陣能夠反映藥物之間的相似性和差異性,從而提高 CNN 的學習能力和泛化能力。
3)他們設計一個新的 CNN 網絡結構,該結構包括一個輸入層,一個卷積層,一個展平層,三個全連接層和一個輸出層,以及一些批量歸一化層和丟棄層,用于提高模型的穩定性和防止過擬合。
4)他們使用 Adam 優化器和分類交叉熵損失函數來訓練模型,這些都是目前深度學習領域的先進技術,能夠提高模型的收斂速度和效果。
5)他們在 DrugBank 數據庫上進行了廣泛的實驗,該數據庫是目前最全面和最權威的藥物數據庫之一,包含了大量的藥物和相互作用信息。他們對不同的超參數和特征組合進行了不同的實驗,以找到最優的模型配置和特征選擇。
6)他們還進行了兩種不同的統計測試來評估他們的方法與其他方法的性能差異,這些測試能夠客觀地反映他們的方法的優越性和可靠性。
研究應用前景主要有以下幾個方面。
- 他們的方法對于藥物的安全性和有效性具有重要的意義,因為他們的方法能夠幫助醫生和藥師避免不良的 DDI,從而提高藥物治療的質量和效果。他們的方法也為藥物的開發和評價提供了一個有用的工具,可以加快藥物的上市和推廣。
- 他們的方法為藥物的機制和功能的研究提供了一個新的視角和方法,可以揭示藥物的復雜性和多樣性。他們的方法也可以用于探索藥物的新的相互作用和作用方式,從而發現新的藥物或新的藥物組合。
- 他們的方法也可以推廣到其他領域,如基因、蛋白質、代謝物等,用于分析和預測它們之間的相互作用和功能。他們的方法也可以與其他 AI 技術,如自然語言處理、計算機視覺、語音識別等,結合起來,實現更多的多模態數據分析和應用。
背景和動機
藥物間的相互作用(DDI)是指同時或先后服用兩種或兩種以上藥物時,藥物之間所產生的相互作用,而該相互作用可能會導致意想不到的副作用。例如,某些藥物可能會增加或減少另一些藥物的效果,或者引起新的不良反應,從而影響藥物的安全性和有效性。DDI是臨床藥理學和藥物治療中一個重要的問題,也是導致藥物不良事件和醫療成本增加的主要原因之一。
DDI的類型可以根據其發生的機制和結果進行分類。根據機制,DDI可以分為藥效學相互作用和藥動學相互作用。藥效學相互作用是指一個藥物通過相同或相反的藥理作用,改變了另一個藥物對組織或器官的影響。例如,阿司匹林和華法林都是抗凝血藥,如果同時使用,可能會增加出血的風險。藥動學相互作用是指一個藥物改變了另一個藥物在體內的吸收、分布、代謝或排泄,從而改變了另一個藥物的濃度或生物利用度。例如,紅霉素是一種抗生素,它可以抑制肝臟中的細胞色素P450酶,從而減少其他藥物的代謝,導致其他藥物的血藥濃度升高。
根據結果,DDI可以分為協同作用和拮抗作用。協同作用是指兩種或多種藥物的聯合使用,產生了比單獨使用更強的效果。例如,抗癲癇藥物卡馬西平和苯妥英鈉都可以增強γ-氨基丁酸(GABA)的抑制作用,如果同時使用,可以提高抗癲癇的效果。拮抗作用是指兩種或多種藥物的聯合使用,產生了比單獨使用更弱的效果。例如,抗生素青霉素和細胞壁合成抑制劑巴克替爾都可以抑制細菌的生長,如果同時使用,可以降低抗菌的效果? 。
DDI的影響可以是有益的或有害的。有益的DDI可以提高藥物的療效或降低藥物的毒性,從而優化藥物治療的效果。例如,抗結核藥物利福平和異煙肼的聯合使用,可以增強抗結核的效果,同時減少耐藥性的發生。有害的DDI可以降低藥物的療效或增加藥物的毒性,從而導致藥物治療的失敗或不良事件的發生。例如,抗高血壓藥物利尿劑和非甾體抗炎藥物的聯合使用,可以降低利尿劑的降壓效果,同時增加腎功能損害的風險 。
DDI的檢測方法可以分為實驗室方法和臨床方法。實驗室方法是指在體外或動物模型中,通過觀察藥物之間的化學反應或生物反應,來預測或驗證DDI的可能性或程度。例如,通過測定藥物對細胞色素P450酶的抑制或誘導作用,來評估藥物對代謝酶的影響。臨床方法是指在人體中,通過觀察藥物之間的藥效或藥動學參數的變化,來確定或評價DDI的存在或嚴重性。例如,通過測定藥物的血藥濃度或藥效指標,來評估藥物的相互作用 。
隨著藥物種類的增加和藥物治療的復雜化,DDI的發生率和危害性也越來越高,給臨床醫療帶來了巨大的挑戰。因此,及時、準確、有效地預測DDI,對于保障藥物的安全性和有效性,優化藥物治療的效果,降低藥物不良事件和醫療成本,具有重要的意義。然而傳統的DDI檢測方法存在一些局限性,如耗時、耗費、不全面、不及時等,難以滿足臨床的需求。因此,利用人工智能(AI)技術,尤其是深度學習技術,來輔助DDI的預測,成為了近年來的研究熱點和發展趨勢 。
AI技術在DDI預測中的作用和挑戰
AI技術利用計算機系統或其他智能設備,模擬或擴展人類的智能,實現各種復雜的任務的技術。AI技術包括多個子領域,如機器學習、深度學習、自然語言處理、計算機視覺、語音識別等。AI技術在醫學領域有著廣泛的應用,如醫學影像分析、醫學文本挖掘、醫學診斷和決策支持、醫學知識圖譜構建等 。
AI技術利用多種數據源,如藥物的化學結構、分子描述符、藥物靶點、藥物途徑、藥物標簽、藥物文獻、藥物數據庫等,來提取和整合藥物的多維特征,從而實現對藥物的全面和深入的理解和表征。
AI技術使用多種模型和算法,如神經網絡、圖神經網絡、卷積神經網絡、循環神經網絡、注意力機制、自編碼器、生成對抗網絡等,來建立和優化藥物的預測模型,從而實現對DDI的精確和高效的預測和分類。
AI技術采用多種評估和驗證方法,如準確率、召回率、精確率、F1分數、AUC、AUPR、混淆矩陣、ROC曲線、PR曲線、配對t檢驗、方差分析等,來評估和驗證預測模型的性能和可靠性,從而實現對DDI的客觀和科學的評價和分析。
方法和原理
多模態卷積神經網絡 (MCNN) 是一種能夠處理和融合不同模態數據的深度學習方法。模態是指數據的類型,如文本、圖像、音頻、視頻等。不同模態的數據包含了不同的信息和特征,通過有效地結合它們,可以實現對復雜問題的更全面和準確的理解和分析。
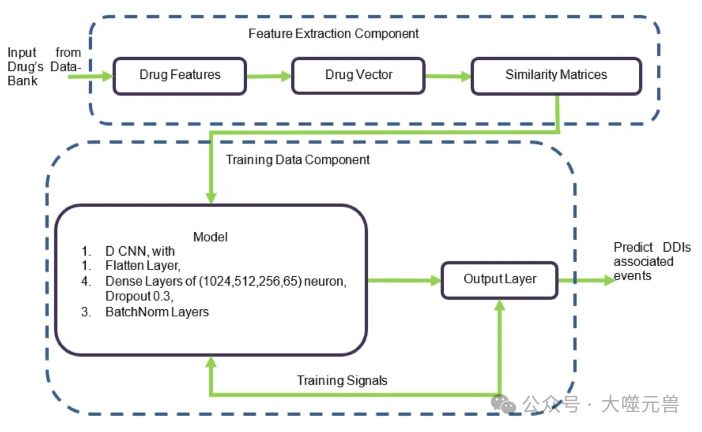 圖1:DDI 的框架架構。
圖1:DDI 的框架架構。
MCNN 的核心思想是使用多列并行的卷積神經網絡 (CNN) 來提取不同模態數據的特征,并將它們融合為一個統一的輸出。每列 CNN 的卷積核大小不同,以適應不同模態數據的特征尺度。MCNN 可以根據不同的任務和數據集,靈活地設計不同的網絡結構和參數。
論文作者的方法是基于 MCNN 的 DDI 預測方法,該方法利用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。論文作者的方法的具體步驟和細節如下:
第一步,提取藥物特征。論文作者從 DrugBank 數據庫中獲取了 572 種藥物的信息,包括它們的化學結構(以 SMILES 表示)、酶、途徑和靶點等。論文作者使用編碼層將每種藥物的信息轉換為一個位向量,其中 1 表示藥物中存在該化合物,0 表示不存在該化合物。例如,酶可以由 202 維的位向量表示,靶點可以由 1162 維的位向量表示,化學子結構可以由 808 維的位向量表示。
第二步,計算藥物對的相似性。論文作者使用 Jaccard 相似度來計算每對藥物之間的相似性,該相似度是指兩個集合的交集與并集的比值。論文作者將每種藥物的位向量視為一個集合,然后計算它們的交集和并集的大小,從而得到相似度矩陣。相似度矩陣的大小為 572 x 572,其中每個元素表示一對藥物的相似度,范圍在 0 到 1 之間。相似度矩陣可以反映藥物之間的相似性和差異性,從而有助于 CNN 學習藥物的特征和相互作用。
第三步,構建多模態 CNN 網絡。論文作者使用四個并行的 CNN 子模型來處理不同的藥物特征,即化學結構、酶、途徑和靶點。每個 CNN 子模型的結構如下:
- 輸入層:接收相似度矩陣作為輸入,大小為 572 x 572 x 1。
- 卷積層:使用不同的卷積核大小和濾波器數量來提取特征,例如,化學結構使用 5 x 5 的卷積核和 32 個濾波器,酶使用 3 x 3 的卷積核和 16 個濾波器,途徑使用 7 x 7 的卷積核和 64 個濾波器,靶點使用 9 x 9 的卷積核和 128 個濾波器。卷積層使用“tanh”作為激活函數,以同時使用正值和負值,因為相似度矩陣中可能存在負值。
- 展平層:將卷積層的輸出轉換為一維的向量,以便輸入到全連接層。
- 全連接層:使用三個全連接層,分別有 1024、512 和 256 個神經元,用于進一步提取和融合特征。全連接層使用“elu”作為激活函數,以增加非線性和穩定性。全連接層還使用批量歸一化層和丟棄層,以防止過擬合和加速收斂。
- 輸出層:使用一個全連接層,有 65 個神經元,對應于 65 種不同的 DDI 相關事件。輸出層使用“SoftMax”作為激活函數,以輸出每種事件的概率分布。
第四步,融合多模態 CNN 的輸出。論文作者使用一個全連接層,將四個 CNN 子模型的輸出融合為一個統一的輸出,大小為 65 x 1,表示每種 DDI 相關事件的預測概率。論文作者使用“SoftMax”作為激活函數,以保證輸出的概率之和為 1。
第五步,訓練和評估多模態 CNN 網絡。論文作者使用 Adam 優化器和分類交叉熵損失函數來訓練模型,這些都是目前深度學習領域的先進技術,能夠提高模型的收斂速度和效果。論文作者使用準確率、精確率、召回率、F1 分數和 AUPR 等評估指標來評估模型的性能,這些指標可以反映模型的準確性、靈敏度、特異度和平衡性。論文作者還使用配對 t 檢驗和方差分析來評估模型與其他方法的性能差異,這些檢驗可以反映模型的顯著性和可信度。
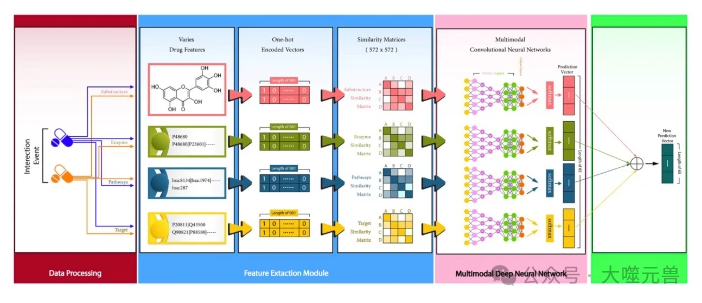 圖2:所提出的模型命名為MCCN-DDI。
圖2:所提出的模型命名為MCCN-DDI。
實驗和結果
論文作者在 DrugBank 數據庫上進行了廣泛的實驗,該數據庫是目前最全面和最權威的藥物數據庫之一,包含了大量的藥物和相互作用信息。作者使用了 572 種藥物和 74528 個相互作用作為數據集,其中 80% 用于訓練,10% 用于驗證,10% 用于測試。作者對不同的超參數和特征組合進行了不同的實驗,以找到最優的模型配置和特征選擇。
作者使用準確率、精確率、召回率、F1 分數和 AUPR 等評估指標來評估模型的性能,這些指標可以反映模型的準確性、靈敏度、特異度和平衡性。論文作者的實驗結果如表 3 所示,其中展示了單個特征和一組特征的結果。從表 3 中可以看出,化學結構是最重要的藥物特征,其準確率達到了 0.8861,而酶是最不重要的藥物特征,其準確率僅為 0.6808。當使用兩組或三組特征時,模型的性能有所提高,其中化學結構、靶點和酶的組合達到了最高的準確率 0.9000。然而,當使用所有四組特征時,模型的性能反而有所下降,其準確率為 0.8953。這可能是因為特征之間存在一定的冗余或噪聲,導致模型過擬合或混淆。
論文作者還使用配對 t 檢驗和方差分析來評估模型與其他方法的性能差異,這些檢驗可以反映模型的顯著性和可信度。作者將他們的方法與以下幾種方法進行了比較。
DDIMDL:這是一種基于多模態深度神經網絡的 DDI 預測方法,使用了藥物的化學結構、酶、途徑和靶點等特征,以及基于余弦相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。
DeepDDI:這是一種基于深度神經網絡的 DDI 預測方法,使用了藥物的分子描述符和指紋等特征,以及基于歐氏距離的相似度矩陣,來預測 86 種不同的 DDI 相關事件。
RF:這是一種基于隨機森林的 DDI 預測方法,使用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。
KNN:這是一種基于 K 最近鄰的 DDI 預測方法,使用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。
LR:這是一種基于邏輯回歸的 DDI 預測方法,使用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。
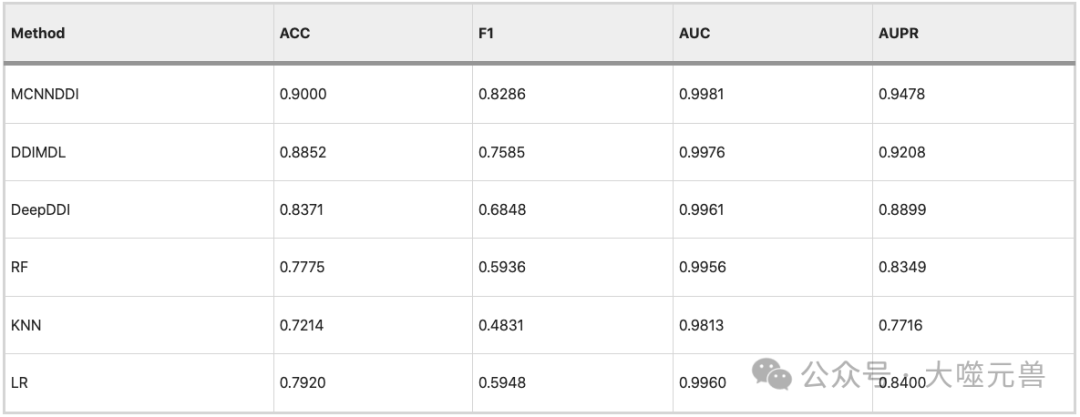 論文表4:MCNN-DDI與其他模型的結果比較。
論文表4:MCNN-DDI與其他模型的結果比較。
論文作者的比較結果如論文表 4 所示,其中展示了不同方法在不同評估指標上的表現。從表 4 中可以看出,作者的方法在所有評估指標上均優于其他方法,而 LR 方法與其他方法的相關性較差。作者的方法實現了高精度,AUPR 值分別為 0.9000 和 0.9478,證明了其優越性。配對 t 檢驗和方差分析的結果表明,作者的方法與其他方法之間的性能差異是顯著的和穩定的,具有統計學意義。
討論和總結
使用多模態 CNN-DDI處理藥物間相互作用的研究是一項重要的 AI 領域醫學應用,他們提出了一種基于多模態 CNN 的 DDI 預測方法,該方法利用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。他們的方法在準確率和 AUPR 等評估指標上均優于其他方法,并且能夠有效地識別不同類型的 DDI。他們的方法對于藥物的安全性和有效性具有重要的意義,也為藥物的機制和功能的研究提供了一個新的視角和方法。
他們的研究對于藥物的安全性和有效性具有重要的意義,因為他們的方法能夠幫助醫生和藥師避免不良的 DDI,從而提高藥物治療的質量和效果。他們的方法也為藥物的開發和評價提供了一個有用的工具,可以加快藥物的上市和推廣。他們為藥物的機制和功能的研究提供了一個新的視角和方法,可以揭示藥物的復雜性和多樣性。他們的方法也可以用于探索藥物的新的相互作用和作用方式,從而發現新的藥物或新的藥物組合。他們為 AI 領域的多模態深度學習提供了一個新的應用場景和案例,展示了多模態 CNN 的強大能力和潛力。他們的方法也可以推廣到其他領域,如基因、蛋白質、代謝物等,用于分析和預測它們之間的相互作用和功能。他們的方法也可以與其他 AI 技術,如自然語言處理、計算機視覺、語音識別等,結合起來,實現更多的多模態數據分析和應用。
論文作者的研究是一項重要的 AI 領域醫學應用,他們提出了一種基于多模態 CNN 的 DDI 預測方法,該方法利用了藥物的化學結構、酶、途徑和靶點等特征,以及基于 Jaccard 相似度的相似度矩陣,來預測 65 種不同的 DDI 相關事件。他們的方法在準確率和 AUPR 等評估指標上均優于其他方法,并且能夠有效地識別不同類型的 DDI。他們的方法對于藥物的安全性和有效性具有重要的意義,也為藥物的機制和功能的研究提供了一個新的視角和方法。他們的研究具有創新性、局限性和前景性,值得我們進一步關注。
參考資料:https://www.nature.com/articles/s41598-024-54409-x







































